Cuando la pandemia de COVID-19 alcanzó con toda su fuerza durante marzo de 2020 y las pruebas de uso autorizado de emergencia (EUA) esron disponibles para medir el SARS-CoV-2, ¿estaba listo su laboratorio? ¿Sabías lo que tenías que hacer antes de implementar las nuevas pruebas? En CLSI, sabemos que el período de tiempo fue (y todavía puede ser) difícil y estresante para su laboratorio, con muchas incógnitas. Para ayudarle a prepararse para el próximo evento de emergencia, reunimos a un grupo de trabajo de expertos para consolidar la información sobre la implementación de estas nuevas pruebas de laboratorio. Designado como EP431 «Implementación de una prueba de laboratorio en condiciones de uso de emergencia», que se espera que se publique a finales de este año, se espera que este nuevo documento técnico contenga una gran cantidad de información útil para su laboratorio.
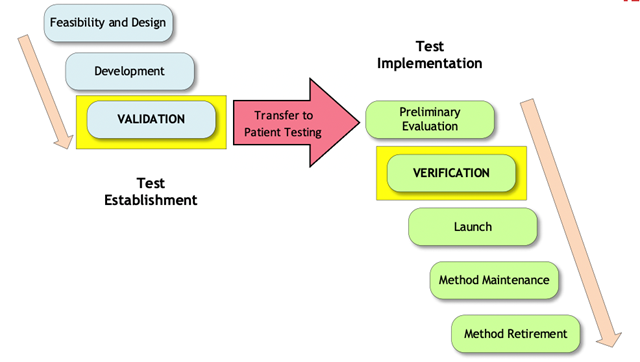
Debido a que las emergencias de salud pública son poco frecuentes, y debido a que cada emergencia de salud pública puede tener diferentes reglas y condiciones que pueden cambiar con el tiempo, siempre es importante que el laboratorio revise los sitios web de los reguladores y acreditadores para obtener la información más reciente. Como ejemplos en el libro blanco, el grupo de trabajo comparó y contrastó los recientes requisitos de emergencia de ébola y COVID-19. Sin embargo, en cualquier situación de emergencia, hay pasos básicos para prepararse, implementar y mantener la prueba de la UCE. El nuevo documento técnico ep43 enumerará muchos de estos pasos, siguiendo el modelo de fase de vida útil de la prueba (Figura 1). La figura muestra las dos etapas principales del desarrollo de pruebas, Establecimiento de pruebas e Implementación de pruebas. Dentro de cada una de estas etapas, se muestran las distintas fases.
Figura 1. Modelo de fase de vida útil de la prueba
El desarrollador de pruebas es responsable de las fases en el lado de «Establecimiento de prueba», y el laboratorio es responsable de las fases en el lado de «Implementación de prueba». Algunos desafíos muy reales pueden presentarse a medida que el laboratorio intenta continuar con las fases de implementación de la prueba. Muchos factores deben ser considerados antes de comenzar las pruebas, tales como:
- Qué pruebas seleccionar.
- Probable impacto en los volúmenes de pruebas de laboratorio, las horas operativas, el personal y la capacitación cruzada.
- Disponibilidad de reactivos y consumibles.
- Requisitos de presentación de informes a las autoridades locales, estatales o federales.
- NECESIDADES DE LIS y/o TI.
- Evaluaciones de riesgos de bioseguridad y bioseguridad.
Una vez que la prueba está dentro del laboratorio, se pueden realizar preocupaciones adicionales, tales como:
- Disponibilidad de muestras positivas para pruebas de verificación.
- Determinación de protocolos para las pruebas de verificación (especialmente dada la información limitada en el etiquetado del producto).
- Necesidades de formación y cualificación.
- Prueba confirmatoria de positivos, si es necesario.
- Facturación y reembolso.
- Evolución de los requisitos.
Después de todo el arduo trabajo de planificación, implementación y uso de la prueba eua sobre una base diaria, puede o no puede recibir la autorización reglamentaria o la aprobación para el uso de rutina. En cualquier caso, dejará de estar cubierta por la UCE. En ese momento, será importante asegurarse de que los estudios de verificación originales se ajustan a los parámetros del etiquetado del producto aprobado o aprobado. De lo que no es así, es posible que se necesiten nuevos estudios de verificación, o que la prueba deba retirarse del uso y reemplazarse con una prueba aprobada o aprobada diferente, comenzando el proceso de nuevo.